Cuando comenzó todo el asunto del coronavirus que ahora conocemos como SARS-CoV-2, la comunidad científica de Uruguay reaccionó con velocidad. Incluso antes de que el virus llegara al país o que tuviera su nombre actual, varios grupos de distintos centros se pusieron a analizar las secuencias genéticas que acababan de hacerse conocer de la variante que provocó el brote de Wuhan, en China. El virus finalmente arribó a estas tierras en marzo de 2020. Para entonces decenas de investigadoras e investigadores ya venían estudiándolo y pensando qué podrían aportar desde sus respectivas áreas de conocimiento. En mayo de 2020 salió publicado el primer trabajo de científicos de Uruguay sobre el nuevo coronavirus en una revista internacional arbitrada. Nuestra ciencia estaba a la altura de las circunstancias.
Pero no se trataba sólo de generar conocimiento. La comunidad científica de Uruguay trabajó intensamente para que el país estuviera preparado para enfrentar lo que veíamos que estaba pasando en países como Italia y España: saturación de servicios de salud, escasez de test diagnósticos, insuficiencia de camas de CTI y equipos de asistencia respiratoria, entre otras cosas. Tal vez el ejemplo más notorio de todo esto, pero no el único, fue el desarrollo de kits de diagnóstico de covid-19 –así se había bautizado la enfermedad que provoca el virus– en un proyecto en el que trabajaron investigadoras e investigadores de la Facultad de Ciencias de la Universidad de la República (Udelar) y el Institut Pasteur de Montevideo, pero que además contó con aportes de casi todos los centros de ciencia. Ante una pandemia que afectaba a todo el mundo, nuestra ciencia nos daba soberanía y autonomía.
Los aportes se sumaron desde distintas disciplinas. A la formación del Grupo Asesor Científico Honorario, el GACH, que cumplió el rol de asesorar en ciencia respecto del coronavirus al Estado y a la sociedad, podrían sumarse otras iniciativas, como la del Grupo Interdisciplinario de Análisis de Datos de Covid-19, el GUIAD, y distintos grupos que trabajaron en temas relacionados con la pandemia no sólo en las facultades de Ciencias, Medicina y Química, sino también en Psicología, Arquitectura e Ingeniería, por decir algunas. La ciencia hacía sus aportes y contribuyó a que 2020 cerrara con un balance que nos colocaba como una excepción en el continente. Luego las cosas se salieron de control, pero eso no es lo relevante para esta nota.
Cuando el nuevo coronavirus nos mostró su cara más atroz, en 2021, ante la negativa a explorar otras medidas, todas las esperanzas se centraron en la vacunación. Las vacunas dieron su resultado meses después. Lo siguen dando hoy. Sin embargo, allí la única soberanía que nos quedaba era decidir a quién comprárselas, cómo administrarlas y, luego, de qué formas combinarlas. El asesoramiento de la comunidad científica y médica siempre estuvo presente, pero la ciencia nacional tenía poco margen para estar en la primera línea del combate al coronavirus. Hay varias razones para ello, entre otras que recién en el último semestre de 2020 la Udelar inauguró en Salto el único laboratorio con bioseguridad P3, es decir, que permite trabajar en condiciones seguras con patógenos de peligrosidad para humanos. Más de un año le llevó al laboratorio salteño estar operativo. También a fines de 2021 se dieron los primeros pasos hacia un instituto de vacunas nacional, ante la incapacidad instalada en el país de desarrollar vacunas para humanos. La soberanía se construye y la comunidad científica tomaba la iniciativa.
Por todo esto antes expuesto, a fines de enero, cuando se publicó en la prestigiosa revista Proceedings of the National Academy of Sciences el artículo “Sondas químicas a base de tiol exhiben actividad antiviral contra el SARS-CoV-2 a través de la interrupción alostérica del disulfuro en la glicoproteína spike”, una inmensa alegría me infló el pecho.
Los primeros autores del artículo fueron Yunlong Shi, Caitlin Edwards y Ari Zeida. Y allí hay algo fascinante que origina esta nota: Ari Zeida es investigador del Departamento de Bioquímica y del Centro de Investigaciones Biomédicas (Ceinbio) de la Facultad de Medicina de la Udelar. Allí, en el Ceinbio, investigan otros dos de los cuatro científicos de Uruguay que firmaron el trabajo: Santiago Sastre y Rafael Radi, que además es uno de los tres autores correspondientes. Sí, el mismo Radi que coordinaba el GACH: mientras asesoraba sobre la pandemia a las autoridades, encontraba tiempo y espacio en su buffer para, junto a sus colegas, buscar en el laboratorio los puntos débiles del SARS-CoV-2. También es autor del artículo Matías Machado, de la Unidad de Ingeniería de Proteínas del Institut Pasteur de Montevideo. Pero nuestros cuatro mosqueteros no están solos. El trabajo lleva la firma, además, de investigadores de peso de instituciones estadounidenses y chinas. Yunlong Shi y Kate Carroll hacen su ciencia en el Departamento de Química del Instituto Scripps Research de Florida. Caitlin Edwards, Michael Mallory, Ralph Baric, Raymond Pickles y Richard Boucher hacen lo suyo en la Universidad de Carolina del Norte. Finalmente, Ling Fu, Keke Liu y Jing Yang aportaron su parte desde el Centro de Investigación Proteómica de Beijing.
Para quienes no están muy cercanos a cómo se produce el conocimiento científico, vale aclarar que en ciencia nada es instantáneo. Publicar un artículo en enero de 2022 implica haber estado trabajando arduamente desde mucho tiempo atrás. En este caso, nuestros cuatro investigadores venían dándole la vuelta al asunto desde febrero de 2020. Y lo que ahora dan a conocer no es nada más ni nada menos que una nueva estrategia para frenar la infección del coronavirus en la primera línea de combate, es decir, en las vías respiratorias altas, que es, justamente, por donde ingresa. Bajo el radar, trabajando en el laboratorio y frente a la computadora con el silencio que impone no tener resultados para mostrar y evidencia sólida, también había ciencia soberana para darle bofetadas al coronavirus. Y la alegría es mayor cuando comprendemos que, así como está el grupo de Zeida, Machado, Sastre y Radi, otras investigadoras e investigadores pueden estar intentándolo en este mismo instante.
Por eso ahora les propongo ir al encuentro de Ari Zeida, Matías Machado y Rafael Radi, para conocer más cómo es que se pusieron a trabajar con tioles, compuestos químicos que tienen grupos funcionales formados por un átomo de azufre y otro de hidrógeno, que tienen la capacidad de desarmar la proteína spike o de espícula del coronavirus. Lo que encontraron es que al reducir enlaces de una región de esa proteína, la espícula que el coronavirus usa como llave para abrir la puerta de la célula a través de la cerradura que es el receptor ACE2, la estructura tridimensional de la proteína se altera y pierde su capacidad de ingresar a las células humanas. Y, como sabemos, los virus necesitan entrar a la célula para hacer copias de sí mismos. Si el virus no logra entrar a las células, tiene sus días contados.
Los inicios de una nueva estrategia para combatir el SARS-Cov-2
En el trabajo publicado, Ari, Machado, Sastre y Radi, junto con sus colegas internacionales, reportan que dos compuestos basados en tioles, llamados P2119 y P2165, “actúan como agentes reductores”, es decir que desarman mediante una reacción química partes de la proteína spike, específicamente en la región del dominio de unión al receptor, “inhibiendo la infección por coronavirus humanos, incluido el SARS-CoV-2, y disminuyen la unión de la glicoproteína espiga a su receptor, la enzima convertidora de angiotensina 2 (ACE2)”.
El efecto antiviral lo observaron en experimentos de infección en células humanas realizados en Estados Unidos. Pero una cosa es ver un efecto y otra distinta, entender el mecanismo mediante el que se produce. Así que con una batería de herramientas y análisis, desde la proteómica, simulaciones computacionales y ensayos de bioquímica, biofísica y biología redox, lograron comprender cómo estos compuestos hacían eso que buscaban. Sin entrar en demasiados detalles, esa reducción que producen estos dos compuestos con tioles afecta los puentes de disulfuros de cuatro cisteínas de la región del dominio de unión al receptor de la proteína spike del coronavirus (si quieren jugar a la quiniela, a los números 2119 y 2165 pueden sumarle que la cisteína más afectada es la Cys432).
En el trabajo comunican que sus hallazgos colectivos “establecen la vulnerabilidad de los coronavirus humanos a las sondas químicas basadas en tioles y sientan las bases para desarrollar compuestos de esta clase como una estrategia para inhibir la infección por SARS-CoV-2”. Pero además hay otra buena nueva: como los compuestos P2119 y P2165, que son los que producen este efecto de alterar la estructura de la proteína spike del coronavirus, ya son conocidos y se están usando para el tratamiento de otras enfermedades respiratorias mediante inhaladores, ya hay ensayos clínicos con protocolos aprobados con ellos. Recurrir a compuestos que ya han sido aprobados acorta los tiempos en que podrían verse algunos desarrollos. Pero no nos precipitemos. Volvamos al inicio.
“Todavía en estado de prepandemia en Uruguay, en febrero de 2020, comienzan a aparecer las estructuras resueltas de las proteínas del SARS-CoV-2. En particular comienzan a salir trabajos que muestran la estructura de la proteína spike, la glicoproteína espicular”, recuerda Ari Zeida, uno de los tres autores principales del artículo. “Simplemente del interés de empezar a mirar esas estructuras y de entender cómo funcionaba esa proteína comenzamos a conversar con Rafael [Radi]. Luego comencé a conversar también con Matías [Machado], con quien trabajamos juntos desde hace muchos años”, agrega Zeida.
Cuando la pandemia finalmente llegó a nuestro país, se preguntaron qué podían aportar desde sus casas, porque, como muchos, al principio no estaban yendo a sus lugares de trabajo. “Como con Matías ya teníamos experiencia en simulaciones computacionales, había cosas que podíamos hacer sin salir de casa. Allí comenzó la idea de trabajar alrededor de la proteína spike, y en particular mirando con lupa lo que se llaman los enlaces disulfuro”, cuenta Zeida.
Para entender por qué miraban los disulfuros, Zeida nos brinda un pantallazo sobre bioquímica y biofísica de las proteínas. “Las proteínas están compuestas por una cadena lineal de aminoácidos que se pliegan en una estructura tridimensional”, explica. La estructura es importante porque está relacionada con la función, es decir, con lo que hace la proteína. “Ese link entre estructura y función de las proteínas es el que nos genera hipótesis de trabajo. Si vemos que la proteína tiene cierta estructura, tratamos de entender la forma en la que actúa esa proteína”, dice Zeida. En esa cadena de aminoácidos de las proteínas hay unos que se llaman cisteínas, que cuando se unen entre ellos forman enlaces o puentes de disulfuro a los que Machado, coautor del trabajo, apoda “tirantes moleculares”, ya que ayudan a que la estructura de la proteína se mantenga.
Esos disulfuros, que son importantes para darles estructura a las proteínas, fueron lo primero que comenzaron a mirar en la proteína spike del coronavirus, en particular los que están en el dominio de unión al receptor de las células humanas, donde vieron que hay cuatro disulfuros muy conservados. “Empezamos a mirarlos con atención, viendo cómo se comportaban, qué características tenían y si era posible de alguna forma romper alguno de ellos y, en caso de que se rompiera alguno, qué podía pasar con la proteína spike”, recapitula Zeida, mostrando que no siempre está bueno desestimular a los niños y las niñas a quienes les gusta romper cosas. “En estas discusiones, que al principio eran teóricas con base en los trabajos que se estaban publicando, apareció la oportunidad, a través del contacto que Rafael tiene con el grupo dirigido por Kate Carroll, del Instituto Scripps Research de Estados Unidos, de trabajar con ellos”.
Matías Machado, Rafael Radi, Ari Zeida y Santiago Sastre en facultad de Medicina. Foto: Alessandro Maradei
Colaboración internacional con protagonismo local
“De febrero a abril de 2020 transcurrieron esos análisis de Ari, Santiago y Matías y esas conversaciones sobre la estructura de la proteína y cómo podía llegar a modificarse”, dice Rafael Radi, orgulloso de haber juntado tres generaciones de investigadores: mientras Zeida y Machado están en sus 40 años, Santiago Sastre es estudiante de doctorado de Programa de Desarrollo de las Ciencias Básicas de Radi y Zeida. “Es decir que en esto hay tres generaciones de científicos uruguayos: el estudiante de doctorado, dos investigadores jóvenes que están en plena expansión de sus carreras y yo, que soy el veterano. Eso está lindo porque de alguna forma construye capacidades”, repasa sin ocultar su alegría. Sin embargo, en esas etapas ya veían que tendrían un grave problema por delante.
“Teníamos una limitación muy importante: cualquier cosa que nos planteáramos la íbamos a poder hacer sólo en la proteína, pero no en el virus”, dispara Radi, en relación a que en ese entonces ni siquiera estaba operativo el laboratorio P3 de la Udelar en Salto. “Si bien desde el punto de vista de la bioquímica de las proteínas Matías y Ari la iban a gastar, veía que íbamos a tener una cierta incapacidad de pasar al siguiente nivel, porque nos íbamos a dar la cabeza contra la pared al no poder hacer el experimento crucial, que era ver esto en los virus”, confiesa Radi. Algo de eso ya lo torturaría cuando en abril, por otro tema, tuvo un Zoom en el que también participó Kate Carroll, del Instituto Scripps Research de Estados Unidos.
“En el chat, por el costado del motivo del Zoom, le conté en lo que estábamos y ella me contó en qué estaban ellos. Le planteé la posibilidad de hacer una colaboración, porque acá nosotros podríamos trabajar mucho en la parte de bioquímica de las proteínas y de biología molecular”, cuenta Radi. La respuesta, obvia por la publicación del artículo, fue que sí había interés en colaborar.
Es que el grupo de Carroll venía trabajando con los tioles P2119 y P2165. “Ellos tenían los compuestos en su mano y se los pensaban tirar a la proteína para ver qué pasaba. Nosotros veníamos haciéndonos la pregunta desde el otro lado, sobre qué pasaba si rompíamos los disulfuros de la proteína spike. El trabajo en conjunto fue muy sencillo porque estábamos trabajando sobre preguntas parecidas, pero desde ángulos diferentes”, comenta Zeida.
“Estábamos transitando nosotros en Uruguay, Ceinbio y Pasteur, y en Estados Unidos Scripps y la Universidad de Carolina del Norte, las mismas discusiones, pero con enfoques complementarios, uno desde el lado farmacológico y el nuestro del lado proteico, que al final convergían en desarmar esos disulfuros para ver si eso alteraba la unión del virus al receptor y, de esa manera, disminuía la infectividad. Pero nosotros teníamos la pared adelante de que no íbamos a poder hacer la prueba en el virus”, dice Radi.
Con la luz verde de la colaboración en algo más ambicioso y completo de lo que podían lograr trabajando desde Uruguay, salieron a buscar financiación. El primer fondo semilla vino de parte de la convocatoria 2020 de la fundación Manuel Pérez para proyectos relacionados con SARS-CoV-2. Ahí se conformó entonces el grupo entre los investigadores del Ceinbio y el Institut Pasteur. Mientras los colegas extranjeros buscaban su financiación correspondiente, aquí nuestros investigadores accedieron a otros fondos de la Udelar (del Espacio Interdisciplinario y de la Comisión Sectorial de Investigación Científica). El proyecto también contó con fondos de la fundación Richard Lounsbery, de Estados Unidos. “Se trata de una organización benéfica de apoyo a la ciencia y creo que es la primera vez que da financiación para un proyecto de Uruguay”, comenta Radi. Para sus cálculos y el procesamiento de datos se valieron, además, de la infraestructura de cluster.uy.
“La primera parte de la pandemia fue vertiginosa, muchas cosas se discutían con base en lo que aparecía en el día a día. El componente más importante de nuestro aporte es más desde el punto de vista estructural. En la parte inicial hubo un gran aporte de toda la parte redox, con Ari y Rafael, pero luego del lanzamiento del proyecto semilla, se suma el Pasteur, con toda su infraestructura de capacidades para la construcción de proteínas recombinantes y hacer análisis biofísicos”, comenta Machado, no sólo coautor del trabajo, sino ilustrador de la imagen que acompaña esta nota. “El conjunto de capacidades que ya existía en Uruguay se potenció con lo que realizaron los colegas desde Estados Unidos”.
Ya dijimos que en ciencia no hay nada espontáneo. A la hora de pensar estrategias para pegarle al virus, la opción de reducción de enlaces no surge de la nada, sino que se circunscribe en una fuerte trayectoria en el país, con Radi como uno de los grandes exponentes de la biología redox, que estudia reacciones oxidativas con intercambio de electrones. Es por eso que la ciencia básica y la aplicada están intrínsecamente unidas. Los proyectos científicos concretos son las cisteínas, que de alguna forma le da una estructura que va más para el lado aplicado o el básico, pero ambas dependen de que se monte una estructura alineada y sólida, que son las científicas y los científicos formados para poder hacerle preguntas al mundo y diseñar vías para obtener sus respuestas.
En la pandemia Radi tuvo una exposición mediática inusitada. Pero la ciencia siempre es colaborativa y por eso la nota dialoga con tres de los cuatro investigadores locales. Sin embargo, hay un detalle personal de Radi que es importante mencionar: la conversación con Carroll y el inicio de la colaboración internacional fueron en abril de 2020. “Y en abril de 2020, en mi vida, justo comenzaba otra cosa importante, porque arrancaba el GACH”, confiesa Radi. “Este proyecto me daba la oportunidad de sentir que me acercaba más a la virología molecular, un tema en el que no había trabajado, en paralelo al trabajo de asesoramiento, lo que me hacía sentir en una zona de mayor confort, porque no sólo estábamos trabajando en la epidemiología del virus y todo lo que era el GACH, sino que estábamos trabajando, además, en un proyecto concreto”.
El orden de las cosas
Los papers son, de cierta manera, una ficción. No porque lo que dicen es fantasía, ya que, justamente, aportan evidencia que permite o no afirmar determinados conocimientos, sino porque el orden en el que aparecen contadas las cosas no necesariamente es el orden en el que los distintos hechos sucedieron. Por ejemplo, el artículo no explica por qué los investigadores y las investigadoras se enfocaron en los compuestos P2119 y P2165 y no en otros tioles. “Fue un poco como está en el paper y un poco no tan así”, admite Zeida.
“Los colegas de Estados Unidos venían trabajando con estos dos compuestos desde antes y ya se sabía que su forma de acción se da mediante la reducción de disulfuros. Cuando nosotros llegamos a esa información, ya estaba bastante bien determinado que estos compuestos tenían esa actividad antiviral”, agrega. Ciertamente encontrar actividad antiviral, más aún en una pandemia, es un gran paso, pero entender por qué se produce esa actividad es crucial, no sólo para el desarrollo de un producto que los contenga, sino que comprender los secretos de cómo se comportan las proteínas involucradas en la infección de un virus es una base para desarrollos futuros hoy todavía impensados.
“La pregunta entonces fue, sabiendo que estos compuestos tienen actividad antiviral, sabiendo que rompen disulfuros, tratar de determinar cuáles están rompiendo y cómo su ruptura genera cambios de función de la proteína. Eso fue lo que vino luego de conocer esa capacidad antiviral”, dice entonces Zeida.
Mientras los colegas del norte le daban palizas al coronavirus en ensayos con células epiteliales nasales humanas de pulmón y en otras –Vero E6– comprobando el efecto antiviral, aquí buscaban el mecanismo detrás de esa acción. “En un cultivo celular hay muchos disulfuros para reducir, hay muchas proteínas del virus y muchas de las células epiteliales nasales o del pulmón, por ejemplo”, dice Zeida. Saber dónde estaba la ruptura era esencial.
“La proteína ACE2, que es el receptor, también tiene disulfuros”, dice Machado. Y recordemos: la proteína ACE2 es nuestra, está presente en las membranas de nuestras células. A la hora de romper, mejor romper las proteínas del virus que las nuestras. “Una de las hipótesis que venían trabajando en Estados Unidos era que la acción de estos compuestos estaría impactando en los disulfuros del receptor ACE2”, cuenta Machado. “Cuando con Ari nos pusimos a mirar las estructuras, vimos que no había forma de que esos compuestos entraran para atacar a esos disulfuros del receptor”, agrega. “Hacer esa mezcla entre el conocimiento de un tipo de experimento más macroscópico con algo más estructural microscópico fue lo que permitió ir desglosando esos efectos y dando pistas de por dónde teníamos que mirar. Lo que vimos es que todo apuntaba más a algo que pasaba en la proteína spike y no tanto a algo que pasaba en las células humanas”, resume Machado, y eso es lo que terminaron reportando en el artículo.
Como se dice en el trabajo, ambos compuestos P no logran atravesar la membrana celular, lo que hace que sean menos tóxicos, ya que no tienen acción sobre las estructuras y los componentes del tejido del huésped, es decir, en nuestras células. “Ambos compuestos se quedan afuera de la célula, en el medio extracelular. Cuando el virus quiere reconocer el receptor de las células del huésped, que es el ACE2, los compuestos, que están en el medio extracelular, interaccionan con el virus, en particular con la parte de la proteína spike que está hacia afuera del virus”, explica Zeida.
Los investigadores cuentan que hay múltiples compuestos que tienen la capacidad de reducir disulfuros. Algunos, como la N-acetilcisteína, incluso se utilizan mediante aerosoles para reducir los mocos. “Pero la N-acetilcisteína penetra en las células, es muy inespecífica y rompe muchísimos disulfuros. Como estos compuestos que estudiamos se mantienen fuera de la célula, baja la cantidad de disulfuros a los que puede enfrentarse. En particular terminamos demostrando en este trabajo que en ese mar de disulfuros que hay en el medio extracelular los disulfuros de la proteína spike son particularmente el blanco de estos compuestos”, cuenta Zeida contento.
¿Y ahora qué?
“El primer mensaje grande de este trabajo sería que el estado de los disulfuros de la proteína spike de los coronavirus es importante. Si uno perturba los disulfuros de esas proteínas, y en particular del dominio de unión al receptor de los coronavirus, va a tener una alteración de función. Ese es un mensaje que fuimos aprendiendo, porque no sabíamos que era así”, resume Zeida.
Lo que vieron en el trabajo, además, es interesantísimo: esta estrategia de pegarles a los disulfuros de la proteína spike podría servir para combatir a gran parte de los coronavirus humanos, no sólo el SARS-CoV-2. “Esto abre una puerta de estrategia farmacológica, es decir, modificar el estado redox de esa proteína es una estrategia farmacológica. Después uno tendría que ajustar un poco estos compuestos según de qué coronavirus se trate o en qué ambiente están esos disulfuros para que haya especificidad para los que uno quiere romper”, dice Zeida. Radi complementa: “En la información suplementaria del artículo se compara la estructura de distintos coronavirus y mostramos que esto puede ser una estrategia común”.
Esos compuestos que quedan fuera de la célula y alteran la capacidad del virus para unirse a nuestras células son una estrategia que podría ayudar a otras que estamos desplegando para combatir este coronavirus, así como otros ya conocidos e incluso algunos que puedan venir más adelante.
“Estas moléculas seguramente no tengan una acción a nivel muy profundo del tejido, sí a nivel de las capas superficiales, que es en general donde comienza la infección, por eso utilizamos células del epitelio nasal y pulmonar”, dice Radi. “Se trata de una herramienta que es potencialmente potente y que podría ser complementaria a la inmunidad vacunal o a la desarrollada por nuestro propio organismo”, agrega. Mientras gesticula llevando su mano desde la nariz hasta los pulmones, dice que tiene la ventaja de que “su acción apuntaría a la nariz, la parte alta, traqueal, bronquial y pulmonar, a través de una inhalación, evitando que el virus, que a través de la infección se empieza a ubicar en la parte más superficial, penetre y vaya más profundo en los tejidos”.
“A nivel de superficies este mecanismo sería muy eficiente. Perdería eficacia a medida que te vas metiendo hacia dentro del tejido. Allí el rol de la inmunidad clásica es mucho más importante. Por eso se discute mucho si el nivel de anticuerpos neutralizantes que se mide en plasma refleja la capacidad de neutralización en las superficies, por ejemplo, cuando una gotícula te cae en la nariz o la boca. Ahí el partido es un poco diferente, y es ahí donde podrían intervenir este tipo de compuestos, en las etapas iniciales”, agrega Radi. Machado lo complementa: “Por eso es que también se está trabajando en administrar vacunas mediante sprays nasales, buscando generar en el epitelio anticuerpos capaces de salir de los tejidos y trabajar en los intersticios, que es lo que haría este fármaco. De alguna forma es una estrategia complementaria a lo que no te da la vacuna, al menos las que tenemos ahora”.
El trabajo es fascinante. Describe una nueva estrategia para evitar la infección por covid-19 en la primera línea de batalla: las vías respiratorias altas. Explica el mecanismo de acción y por qué los compuestos hacen lo que hacen. Además, los tioles que utilizaron ya son conocidos, se están usando en ensayos clínicos para otros tratamientos. Uno no puede prometer una cura ni un fármaco milagroso en lo inmediato, pero tampoco puede dejar de pensar en lo que podría venir luego.
“Estos compuestos pueden ser administrados mediante un aerosol en la nariz. Algunos están ya en ensayos clínicos y en el futuro se podría pensar en ese tipo de estrategias”, comenta Zeida. “O podría hacerse también de forma más profunda, con inhalaciones broncopulmonares”, conjetura Radi. A las interrogantes se suma otra: ¿seguirá este equipo dando los pasos que siguen o, luego de la descripción de lo que hacen estos compuestos, se pasará a una etapa que caerá en manos de otros equipos de investigación?
“Nosotros tenemos una dependencia de la colaboración para hacer los experimentos que siguen. Por un lado, porque esos compuestos fueron desarrollados por los colegas con los que colaboramos en este artículo, y porque además las infecciones en animales necesarias no las podemos hacer ni siquiera en el laboratorio P3 que tenemos en Salto”, dice Radi, explicando que por el momento allí pueden hacerse infecciones en células (in vitro), pero no en animales (in vivo). “La idea es seguir avanzando en colaboración con nuestros colegas del extranjero, porque la parte básica la vamos a tener que seguir haciendo en paralelo con la parte farmacológica. Ya tenemos algunas pistas de por dónde va a seguir la colaboración y en febrero vamos a tener una reunión de puesta a punto al respecto”, agrega.
En un horizonte probable, mientras en el norte hacen los ensayos preclínicos con modelos animales, por ejemplo en hámsteres, nuestros investigadores piensan seguir abordando otras cuestiones relevantes, como los efectos fuera de blanco o incluso cómo las distintas variantes del nuevo coronavirus se verían o no afectadas por estos compuestos. “Ya estamos poniendo a punto varios ensayos para poder mapear la efectividad de estos dos compuestos más allá de una sola variante para poder estar seguros de que con esta estrategia este coronavirus no tendría forma de escapar”, confiesa Machado. “Si hay algo que tienen los virus es lo sorprendente de cómo encuentran caminos mediante la evolución. Ómicron es eso, algo totalmente inesperado. Poder encontrar que esto sigue funcionando más allá de las variantes sería encontrar un talón de Aquiles importante”, agrega.
“También vamos a hablar con nuestros colegas virólogos en Uruguay de las facultades de Medicina, de Ciencias y del Pasteur para ver si algo de esto lo podemos ir montando acá, más allá de la colaboración con los colegas extranjeros. La idea es ir avanzando en la biología redox en las infecciones virales, aunque no sea específicamente en la línea de lo que estamos haciendo con los colegas internacionales, de manera que quede instalado ese tipo de enfoque en nuestro país y que nos libere de tener que hacer los experimentos de infección en el extranjero, que es algo que te limita, porque siempre implican negociaciones y acuerdos a distancia”, adelanta Radi.
Les hago la última pregunta, que siempre es un poco incómoda. ¿A cuánto se está de que esto que reportan pueda llegar a ofrecer un apoyo al combate del coronavirus? No rehúyen la respuesta. “Nosotros tenemos como mínimo un par de años para trabajar en aspectos básicos, mientras en paralelo, si los astros se alinean y los grupos que pueden hacer los experimentos preclínicos lo empujan, en un año habría suficiente volumen de datos preclínicos como para poder pasar a otra etapa”, dice Radi. Ante mi mirada curiosa, agrega con la precisión de quien acuñó el “Blindemos abril”: “Yo veo esto en una escala de tiempo de mediano plazo, no es que si funciona recién en diez años vamos a poder ver algo. Si todas las voluntades empujan, estas estrategias podrían estar listas en un horizonte de dos años”, aventura Radi.
Gracias a la financiación internacional, el equipo local cuenta con recursos, por lo que suponen que van a seguir trabajando en torno a esta estrategia hasta parte de 2023. “Ojalá que quede establecida una línea de investigación cooperativa en relación con la biología redox e infecciones virales que pueda ir más allá de las enfermedades por coronavirus”, expresa Radi. Consciente de que una nota debe tener un buen cierre, cuando nos despedimos dispara: “En este tema de trabajar con pares y evitar el colonialismo cultural-científico, sobre todo cuando se discuten tratados de libre comercio con países que son muy agresivos en ese sentido, nuestra comunidad académica nacional tiene un ethos basado en lo que representaba Caldeyro Barcia y todo lo que vino después, de manejar las colaboraciones en pie de igualdad. Esta no fue una excepción”.
Artículo: “Thiol-based chemical probes exhibit antiviral activity against SARS-CoV-2 via allosteric disulfide disruption in the spike glycoprotein”
Publicación: Proceedings of the National Academy of Sciences (enero de 2022)
Autores: Yunlong Shi, Ari Zeida, Caitlin Edwards, Michael Mallory, Santiago Sastre, Matías Machado, Raymond Pickles, Ling Fu, Keke Liu, Jing Yang, Ralph Baric, Richard Boucher, Rafael Radi y Kate Carroll.
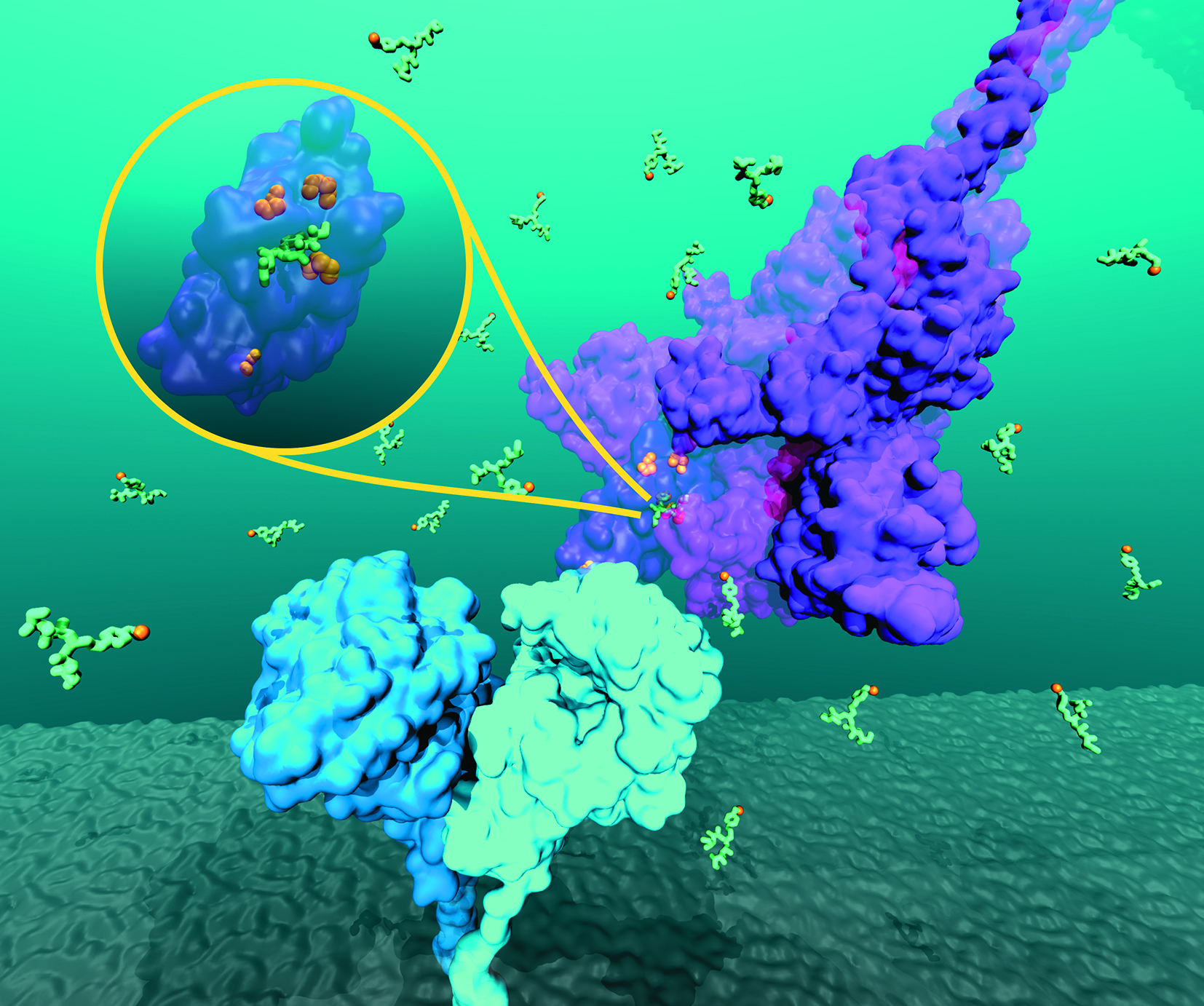 La espícula del coronavirus (violeta) se aproxima para establecer contacto con el receptor ACE2 de la célula humana (cian). Los tioles (amarillos) del compuesto (verde), que está en el medio extracelular, se fijan en el dominio de unión al receptor de la espícula (zona ampliada), donde rompen los puentes de disulfuros, alterando así la estructura de la espícula, que ya no podrá calzar como la llave que abre la cerradura del receptor ACE2. Ilustración: Matías Machado.
La espícula del coronavirus (violeta) se aproxima para establecer contacto con el receptor ACE2 de la célula humana (cian). Los tioles (amarillos) del compuesto (verde), que está en el medio extracelular, se fijan en el dominio de unión al receptor de la espícula (zona ampliada), donde rompen los puentes de disulfuros, alterando así la estructura de la espícula, que ya no podrá calzar como la llave que abre la cerradura del receptor ACE2. Ilustración: Matías Machado.